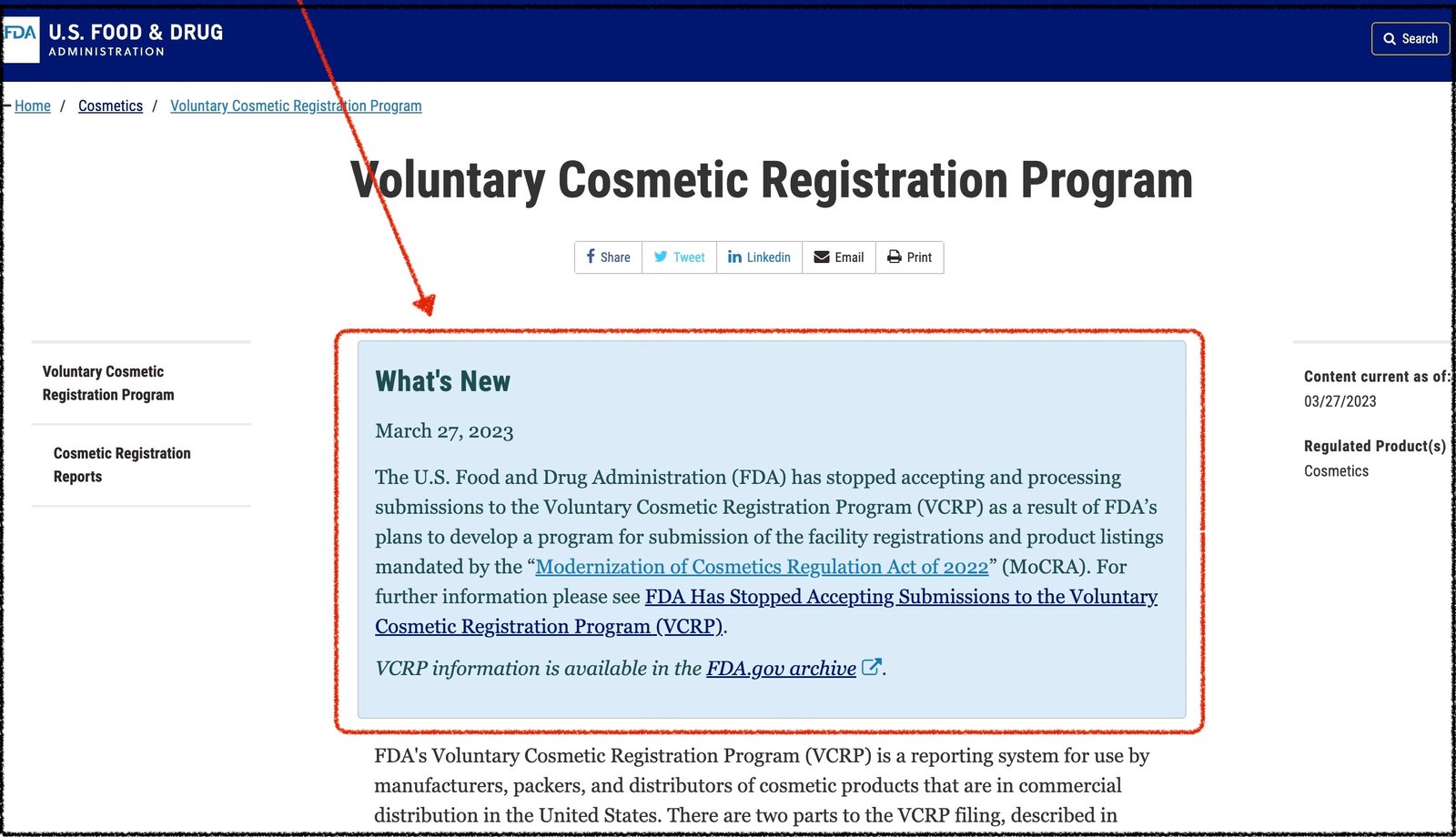
雖然我們是「英文文案撰寫」公司,但8年來因客戶要求,協助不少「海外出口認證申請」,其中一項就是 FDA 中的VCRP 自願登錄。這2天,從 VCRP 的官網首頁,我們發現到 FDA 已於 2023-03-27 ,公佈「美國暫時不再接受 VCRP申請,已註冊商家也無法使用 VCRP登入系統」。您可以寫信給我們,思考下一個「出口到美國」的對策。 寫信給我們 (2小時內一定回您): (https://widermkt.com/contact/)
美國不再受理 VCRP ,有2個原因:
- (1) 自行註冊 VCRP 的「提交量」已過大,VCRP需要更長時間審核,且需要「新系統」來維護
- (2) 因應2022年底「化妝品監管法案現代化」法令 (簡稱: MoCRA) ,所有「進口至美國銷售的化妝品」,需有更嚴格的審格。
FDA聲稱,大多數的美國消費者「每天都使用各種化妝品」。人們平均每天使用 6 – 12 種化妝品。這些產品包括: 化妝品、指甲油、剃須膏和其他美容產品、香水、面部和身體清潔劑、護髮產品、潤膚霜和其他護膚產品。
美國的「化妝品監管法案」,自 1938 年通過聯邦食品、藥品和化妝品 (FD&C) 法案以來,至今少有修改。2022 年12月「化妝品監管現代化法案」 (簡稱: MoCRA) 通過,這是 FDA 對「化妝品」監管權力的最重大擴展。這項新法律將有助於確保化妝品的「安全性」,保護許多美國消費者每天使用各類化妝品。
VCRP 官網上的「暫停VCRP公告」截圖如下。我也會把「MoCAR法令的內容」,完整翻譯在下方:

年化妝品監管法案現代化 -2022(MoCRA)
MoCRA 為「化妝品」行業,製定了以下新要求:
- 不良事件報告:負責人必須在收到報告後 15 個工作日內向 FDA 報告與在美國使用化妝品相關的嚴重不良事件,並在一年內報告某些附加信息,例如新的醫療信息的初步報告。 FDA 還將在檢查期間獲得不良事件報告。
- 設施註冊:製造商和加工商必須向FDA 註冊他們的設施並每兩年更新一次註冊。
如果 FDA 確定由註冊設施生產或加工,並在美國分銷的化妝品有合理的可能性對人類造成嚴重的不良健康後果或死亡,並且該機構有合理地相信該工廠生產或加工的其他產品,可能會因為不能與一個或多個產品隔離的故障,而受到類似的影響 ; 或者足夠普遍引起對該工廠生產的其他產品的擔憂。如果設施的註冊被暫停,則禁止在美國分銷或銷售(或以其他方式引入或交付商業)來自該設施的化妝品。
- 產品清單:負責人必須向FDA 列出每種上市銷售的化妝品,包括產品成分,並每年提供任何更新。
- 安全證明:負責人必須確保並維護記錄以證明其產品具有足夠的安全證明。
MoCRA 還要求行業遵守 FDA 將針對以下方面,製定新的法規:
- 化妝品生產設施的良好生產規範(GMP) 要求。
- 香料過敏原標籤要求。
- 用於檢測和識別含滑石粉化妝品中石棉的標準化檢測方法。
有些化妝品公司,可豁免 MoCRA並 免除小型企業的 GMP、註冊、和產品列表要求。但是,此類豁免不適用於製造或加工以下化妝品的製造商或設施:
- 在慣常或通常使用條件下經常與眼睛粘膜接觸的產品。
- 注射產品。
- 供內部使用的產品。
- 旨在在習慣或通常使用條件下改變外觀超過24 小時且由消費者移除的產品不屬於此類使用條件的一部分。
- 某些受藥物和設備要求約束的產品和設施也有豁免。
暫停多久? 自願化妝品註冊計劃 (VCRP)
FDA說: 「我們停止接受和處理任何提交 VCRP的 化妝品企業和產品。這些公司將無法「自願註冊」此計劃。 FDA 正在製定一項計劃,用於提交 MoCRA 規定的設施註冊和產品清單,並將提供有關其即將推出的可用性的進一步更新」。何時再度開放,要看新系統及新法規的情況而定。